Maddenin Isı ile Etkileşimi Konu Anlatımı

Maddenin Isı ile Etkileşimi Konu Anlatımı: Fizikte ısı ve madde arasındaki etkileşimleri keşfedin. Detaylı bilgiler ve örneklerle.
Sıcaklık nedir?
- Maddenin içerisindeki taneciklerin ortalama hareket enerjisine sıcaklık denir.
- Sıcaklık enerji değildir, enerjinin göstergesidir.
- Sıcaklık termometre ile ölçülür.
- Sıcaklık birimi °C’dir.
Isı nedir?
- Maddenin taneciklerinin toplam hareket enerjisine ısı denir.
- Başka bir tanım olarak sıcak olan maddeden soğuk olan maddeye aktarılan enerjiye ısı denir.
- Isı bir enerjidir.
- Isı kalorimetre kabı ile ölçülür.
- Isı birimi kalori (cal) veya Joule (J)’dür.
- Bir maddenin ısısı doğrudan ölçülemez.
Öz ısı nedir
Bir gram saf maddenin sıcaklığını 1 °C değiştirmek için alınması veya verilmesi için gerekli ısı miktarına öz ısı denir.
Maddenin tutabileceği ısı miktarıdır. Öz ısı “c” sembolü ile gösterilir.
Öz ısının birimi J/g.°C veya cal/g.°C ‘dir.
Not: Öz ısıya ısınma ısısı da denilmektedir.
Öz ısının Özellikleri
- Öz ısı saf maddeler için ayırt edici özelliktir.
- Saf maddelerin öz ısıları da farklıdır.
(Yoğunluk, erime noktası, kaynama noktası, donma noktası da maddenin ayırt edici özellikleridir.)
- Öz ısı maddenin miktarına bağlı olarak değişmez.
- Eşit miktarda farklı cins sıvılara eşit miktarda ısı verildiğinde öz ısısı az olan sıvının sıcaklığı daha fazla artar.
- Eşit miktarda farklı cins sıvıların çevreye verdikleri ısı, öz ısısı fazla olanın daha fazladır.
Not: 1 gram suyun sıcaklığını 1°C artırabilmek için 1 kalori ısı vermek gerekir.
1 cal = 4,18 J dür.
A-Isınmanın Maddenin Cinsine, Kütlesine, Sıcaklık Bağlı Değişimi
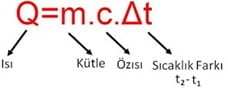
Q=m.c.Δt ısı alışverişinde kullanılan formüldür.
Bu formül ile ısı kütle öz ısı ve sıcaklık arasındaki ilişkiyi göstermek için kullanılacaktır.
Q=m.c.Δt formülünde çarpım durumunda olanlar ters orantılı, bölüm durumunda olanlar ise doğru orantılıdır.
Not: Q=m.c.Δt formülü ile problem çözülmeyecektir.
Isı ve kütle arasındaki ilişki (Q ve m )

Kütle ve ısı doğru orantılıdır.
Aynı sıcaklıkta, aynı türden yapılmış maddelerin kütlesi arttıkça içerisindeki ısı miktarı da artar.
Aynı sıcaklıkta bir bardak su ile bir sürahi suyu aynı sıcaklığa çıkarabilmek için, bir sürahi suya daha fazla ısı verilmelidir.
Örnek: Küçük su şişesine doldurulmuş ve büyük su şişe- sine doldurulmuş aynı sıcaklıkta suların bize verebileceği ısı miktarını karşılaştırınız?

Kütle arttıkça ısıda artar
Aynı sıcaklıkta olmalarına rağmen, kütlesi fazla olan suyun içerisindeki ısı daha fazladır. Bu nedenle büyük şişe içerisindeki su bize daha fazla ısı verir.
Örnek: Sıcaklıkları 70 °C olan, 50 g ve 100 g suya buz parçaları atılmaktadır. Hangi kapta daha fazla buz erir.
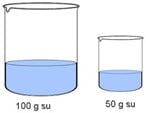
Madde miktarı (kütlesi) fazla olan suyun içerisinde bulunan ısı miktarı da fazla olacaktır. Bu nedenle 100 g su daha fazla buz eritir.
Bağımsız değişken: Suyun kütlesi
Bağımlı değişken: Verdiği ısı
Kontrol edilen değişken: Madde cinsi (öz ısı), sıcaklık değişimi
Isı ve öz ısı arasındaki ilişki (Q ve c)

Isı ve öz ısı doğru orantılıdır.
Kütleleri aynı, öz ısıları farklı maddeleri aynı sıcaklığa getirebilmek için verilmesi geren ısılarda farklı olacaktır. Öz ısısı fazla olan maddeye daha fazla ısı verilmesi gerekmektedir. Öz ısısı yüksek olan maddelerin çevreye verebilecekleri ısı miktarı da fazla olacaktır.
Örnek: 50 g su ve alkole, 10 °C den 50 °C ye getirebilmek için verilmesi gereken ısı miktarları ne olmalıdır? (csu:4,18 calkol:2,54 )
Suyun öz ısısı alkolün öz ısısından fazla olduğu için her iki sıvıyı da aynı sıcaklığa getirebilmek için suya daha fazla ısı vermek gerekir.
Bağımsız değişken: Maddenin cinsi (öz ısı)
Bağımlı değişken: Verilen ısı
Kontrol edilen değişken: Kütle, sıcaklık değişimi
Isı ve sıcaklık arasındaki ilişki (Q ve Δt)

Isı ve sıcaklık doğru orantılıdır.
Bir maddeye ne kadar fazla ısı verilirse sıcaklığı da o kadar artar.
Madde ne kadar ısı verirse sıcaklığı da o kadar azalır.

Örnek: Esra çaydanlıkta hızlıca çay yapmak istediğinde ocağın hangi gözüne çaydanlığı koymalıdır?
Ocağın büyük gözü daha fazla ısı vereceğinden suyun sıcaklık artışı daha fazla olur.
Bağımsız değişken: Verilen ısı
Bağımlı değişken: Sıcaklık değişimi
Kontrol edilen değişken: Madde cinsi (öz ısı), kütle
Kütle ve sıcaklık arasındaki ilişki (m ve Δt)

Kütle ve sıcaklık ters orantılıdır. Madde cinsi, aldıkları ısı aynı olmak şartıyla kütlesi az olanın sıcaklığı fazla artacaktır.
Örnek: Özdeş ısıtıcılara beher içerisinde 50 g ve 100 g miktarında su koyalım. Eşit sürede ısıtalım. 50 g suyun sıcaklığı daha fazla artacaktır.
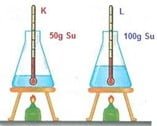
Kütle-sıcaklık değişimi
Bağımsız değişken: Suyun kütlesi
Bağımlı değişken: Sıcaklık değişimi
Kontrol edilen değişken: Madde cinsi (öz ısı), ısıtılma süresi (verilen ısı)
Kütle ve öz ısı arasındaki ilişki (m ve c)

Kütle ve öz ısı ters orantılıdır.
Öz ısı ve sıcaklık arasındaki ilişki (c ve Δt)

Sıcaklık ile öz ısı (maddenin cinsi) ters orantılıdır.
İlk sıcaklıkları aynı su ve yağ özdeş ısıtıcılarla ısıtıldığında sıcaklık değişimi farklı olacaktır.
Madde değiştiği için öz ısıları da değişecektir.
Suyun öz ısısı yağdan büyük olduğu için sıcaklık değişimi az olur.
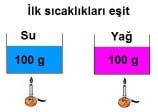
Bağımsız değişken: Madde cinsi (öz ısı)
Bağımlı değişken: Sıcaklık değişimi
Kontrol edilen değişken: Kütle, ısıtılma süresi (verilen ısı)
Özet:
Q: Isı m: Kütle c: Öz ısı
Δt: Sıcaklık farkı
Q=m.c.Δt (Kısaca kör mecit) formülüne göre ısı hepsi ile doğru orantılı, çarpım durumunda olanlar ters orantılıdır.
- Q ve m doğru orantılı
- Q ve c doğru orantılı
- Q ve Δt doğru orantılı
- m ve Δt ters orantılı
- m ve c ters orantılı
- c ve Δt ters orantılıdır
B- Hâl Değişim Isının Maddenin Cinsi ve Kütlesiyle İlişkisi
Maddeler doğada katı, sıvı ve gaz halinde bulunur. Maddenin hallerini moleküller arasındaki çekim kuvveti belirler.
Isı alan bir maddenin molekülleri arasındaki çekim kuvveti zayıflar, moleküller arasındaki mesafe artar.
Katı maddenin tanecikleri arasındaki çekim kuvveti en fazladır.
Gaz maddenin tanecikleri arasındaki çekim kuvveti en azdır.
Maddenin tanecikleri (atom, molekül veya iyonlar) ısı enerjisi aldıkça tanecikleri arasındaki bağlar kopar.
Molekülü oluşturan atomlar arasında kimyasal bağ vardır. Moleküller arasında da çekim kuvveti bulunur.
Bu çekim kuvveti kimyasal bağa göre daha zayıftır.
Bir madde ısı aldıkça hareket enerjileri artar, moleküller arasındaki çekim kuvveti azalır.
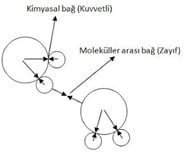
Moleküller Arası Çekim Kuvveti
Tanecikler arasındaki çekim kuvveti maddenin halini belirler.
Katı halde
Maddenin sıcaklığı azdır, taneciklerin titreşim enerjisi de azdır, tanecikler arası çekim kuvveti fazladır.
Sıvı halde
Sıcaklık artmıştır, sıcaklık arttıkça titreşim enerjisi artar, taneciklerin arasındaki çekim kuvveti zayıflar, tanecikler kendi aralarında serbestçe hareket etmeye başlar.
Gaz halinde
Sıcaklık daha da artmıştır, titreşim enerjinin çok fazla olmasından dolayı tanecikler artık bir arada duramaz, serbestçe hareket etmeye başlar. Taneciklerin arasındaki çekim kuvveti en azdır.
| Katı | Sıvı | Gaz | |
| Tanecikler arası çekim kuvveti | Fazla | Orta | Az |
| Tanecikler arası mesafe | Az | Orta | Fazla |
| Taneciklerin hareket enerjisi | Az | Orta | Fazla |
| Titreşim hareketi | Var | Var | Var |
| Öteleme hareketi (Yer değiştirme) | Yok | Var | Var |
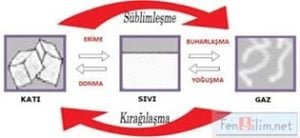
Maddenin Halleri ve Isı Alışverişi
Saf maddeler erime, buharlaşma, kaynama ve süblimleş- me sırasında ısı alır. Saf maddeler donma, yoğuşma ve kırağılaşma sırasında ısı verir.
Saf maddeler erime, donma, kaynama hal değişimleri sırasında sıcaklıkları sabit kalır.
Saf maddeler hal değişimi sırasında aldıkları enerjiyi tanecikleri arasındaki mesafenin artması veya azalması için kullanırlar.
Hal Değişim Isıları
Hal değişim ısıları maddenin ayırt edici özelliğinden biridir. Hal değişim ısıları L ile gösterilir.
Birimi j/g’dır.
1. Erime ısısı
Erime
Maddenin ısı alarak katı halden sıvı hale geçmesine erime denir.
Erime sıcaklığı
Erimenin başladığı sıcaklıktır.
Erime ısısı
Erime sıcaklığındaki 1 g maddenin katı halden sıvı hale geçmesi için gereken ısı miktarıdır. Erime ısısı Le ile gösterilir. Erime ısısının birimi j/g dır.
Erime sıcaklığına gelen madde ısı almasına rağmen sıcaklığında bir artış meydana gelmez. Alınan ısı hal değişimi için kullanılır. Taneciklerin arasındaki bağ koparılır.
Erime ısısı maddenin ayırt edici özelliğidir. Farklı maddelerin erime ısıları da farklıdır.
| Madde | Erime-Donma Isısı(J/g) |
| Kurşun | 22,57 J/g |
| Demir | 117,04 J/g |
| Bakır | 175,56 J/g |
| Alüminyum | 321,02 J/g |
| Cıva | 11,28 J/g |
| Buz | 334.4 J/g |
- Donma ısısı
Donma
Maddenin ısı vererek sıvı halden katı hale geçmesine denir.
Donma sıcaklığı
Maddenin katılaşmaya başladığı sıcaklıktır.
Donma ısısı
Donma sıcaklığındaki 1g saf sıvının katı hale geçmesi için çevreye verdiği ısıdır.
Donma ısısı Ld ile gösterilir. Birimi j/g dir.
Bir madde erime ve donma sıcaklıkları aynıdır.
Bir maddenin erime ve donma ısıları aynıdır. (Le=Ld)
3.Buharlaşma ısısı
Buharlaşma
Maddenin ısı alarak sıvı halden gaz hale geçmesine denir. Buharlaşma her sıcaklıkta olur.
Kaynama
Sıvının içerisinde gaz kabarcıklarının oluşmasıdır. Kaynama hızlı buharlaşmadır.
Kaynama sıcaklığı
Sıvının kaynamaya başladığı sıcaklıktır.
Buharlaşma ısısı
Kaynama sıcaklığındaki 1g sıvıyı gaz haline geçirmek için gerekli ısıdır.
Buharlaşma ısısı Lb ile gösterilir. Birimi j/g dır.
Buharlaşma ısısı maddenin ayırt edici özelliğidir.
Farklı maddelerin buharlaşma ısıları çok farklıdır.
| Madde | Buharlaşma-Yoğuşma Isısı (J/g) |
| Su | 2257 |
| Alkol | 854,97 |
| Eter | 296,78 |
| Aseton | 520,41 |
4.Yoğuşma Isısı
Yoğuşma
Gaz halindeki bir maddenin çevreye ısı vererek sıvı hale geçmesine denir.
Yoğuşma Sıcaklığı
Yoğuşma olayının başladığı sıcaklıktır.
Yoğuşma ısısı
Kaynama sıcaklığındaki 1 g gaz halindeki maddenin sıvı hale geçerken verdiği ısıdır.
Yoğuşma ısısı Ly ile gösterilir. Yoğuşma ısısının birimi j/g dır.
Buharlaşma ısısı yoğuşma ısısına eşittir. (Lb=Ly)
C- Hal Değişim Grafikleri
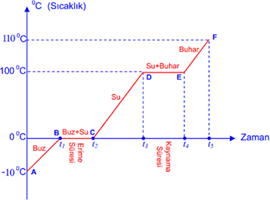
Isınma Eğrisi
-10 °C bulunan buzun ısıtılması ile oluşan sıcaklık-zaman grafiği görülmektedir.
- A-B noktaları arasında Alınan ısı buzun sıcaklığını artırır.
- B-C noktaları arasında buz ve su karışımı vardır. Alınan ısı buzun erimesi için kullanılır. Sıcaklık
- C-D noktaları arasında Alınan ısı suyun sıcaklığını artırır.
- D-E noktaları arasında su ve buhar karışımıdır. Alınan ısı suyun buharlaşması için kullanılır. Sıcaklık sabittir
- E-F noktaları arasında buhardır. Alınan ısı buharın sıcaklığını artırmaktadır.
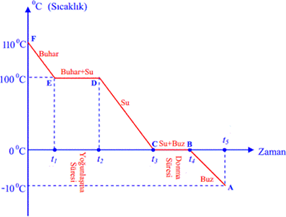
Soğuma Eğrisi
110 °C de bulunan su buharının soğuması ile oluşan sıcaklık-zaman grafiği görülmektedir.
- E-F noktaları arasında buhardır. Buhar ısı kaybederek sıcaklığı azalmaktadır.
- D-E noktaları arasında su ve buhar karışımıdır. Kaybedilen ısı buharın yoğuşmasına neden olur. Sıcaklık sabittir.
- C-D noktaları arasında sudur. Suyun kaybettiği ısı suyun sıcaklığını azaltır.
- B-C noktaları arasında buz ve su karışımı vardır. Su ısı vererek donmaktadır. Sıcaklık sabittir.
- A-B noktaları arasında buzdur. Buzun sıcaklığı giderek azalmaktadır.
D- Günlük Yaşamda Hal Değişimi ve Isı Alışverişi
1.Günlük yaşamda karşılaşılan erime olayları
Erime maddeler çevrelerinden ısı alırlar.
- Dondurmanın, katı yağ, buz sıcakta erir.
- Metaller fabrikalarda eritilerek kalıplara dökülür.
2.Günlük yaşamda karşılaşılan donma olayları
Donan maddeler çevreye ısı verirler.
- Buzdolabının buzluğuna bulunan su ısı vererek donar.
- Kışın soğuk havalarda göl, su ve akarsular donar.
- Kışın meyve-sebze hallerinde, meyve ve sebzelerin donmasını engellemek için su dolu kaplar bırakılır. Su donarken etrafa ısı vereceğinden ortamın aşırı soğuması engellenmiş olur.
3.Günlük yaşamda karşılaşılan yoğuşma olayları
Yoğuşma olayı sırasında madde etrafa ısı verir.
- Yoğuşmalı kombiler su buharı yerine, suyu sıvı halde verir.
- Buzdolabından çıkan su şişesinin etrafında yoğuşmadan dolayı su damlaları oluşur.
- Gökyüzünde su buharı yoğuşarak su damlalarına dönüşür.
1. Günlük yaşamda karşılaşılan buharlaşma olayları
Buharlaşma olayının görüldüğü yerlerde soğuma görülür.
- Elimize dökülen kolonya, elimizde serinlik hissetmemizi sağlar.
Kolonya buharlaşırken ısıyı elimizden alır.
- Toprak testinin içindeki suyu serin tutması buharlaşma ile gerçekleşir.
- Kesilen karpuzun güneş altında soğuması buharlaşma ile gerçekleşir.
- Islak başımızla veya denizden dışarı çıktığımızda üşümemiz buharlaşma ile gerçekleşir.
5. Günlük yaşamda karşılaşılan kırağılaşma olayları
Kırağılaşma olayı sırasında madde dışarıya ısı verir.
- Soğuk havada araçların, ağaçların üzerinde su kırağılaşır.
6. Günlük yaşamda karşılaşılan süblimleşme olayları
- Güve kovucu olarak kullanılan naftalin katı haldedir. Naftalin sıvı hale geçmeden süblimleşerek buharlaşır.
- Lavabolarda kullanılan ernet ısı alarak süblimleşir.
Not: Saf maddelerin erime ve donma sıcaklıkları sabittir.
Saf maddelerin içerisine yabancı madde ilave edildiğinde erime ve donma sıcaklığı düşer.
Suyun içerisine tuz ilave edildiğinde donma sıcaklığı 0°C nin altına düşer.
Suyun içindeki tuz oranı ne kadar fazla ise donma sıcaklığı da o kadar düşük olur.
Not: Saf maddelerin kaynama sıcaklığı sabittir.
Saf maddelerin içerisine yabancı madde ilave edildiğinde kaynama sıcaklığı yükselir.
Su içerisine tuz ilave edildiğinde, tuz oranına bağlı olarak suyun kaynama sıcaklığı 100°C nin üzerine çıkar.






