Asitler ve Bazlar Konu Anlatımı

Asitler ve Bazlar Konu Anlatımı ile kimyanın temel kavramlarını öğrenin. Detaylı bilgiler ve pratik örneklerle.
A- Asitler
Suda çözündüğünde H+ iyonu oluşturan maddelere asit denir.
Asitlerin Genel Özellikleri
- Mavi turnusol kağıdını kırmızıya çevirir.
- Tatları ekşidir (Limon gibi).
- Metaller ile tepkimeye girerek (H2) hidrojen gazının açığa çıkarır. Bu nedenle metal kaplarda saklanmaz.
- Sulu çözeltileri elektrik akımını elitir.
- Tahrip edici özelliğe sahiptir. ( Mermeri aşındırır, kumaşı deler, deriyi yakar )
- Bazlarla tepkimeye girerek tuz ve su oluşturur.
- pH değerleri 7 den küçüktür.
- Sulu çözeltilerinde H+ iyonu oluşturur.
- Ametallerin oksijenli bileşikleri asit özellik gösterir.
Önemli Asitler
HCl—— > H+ + Cl– Hidroklorik asit
HNO3 —–> H+ + NO3 Nitrik asit
H2SO4 —–> 2 H+ + SO4 Sülfürik asit
Not: Asitlerin genel olarak yapısında Hidrojen olduğu gözlenir. Ancak bazı özel durumlar vardır. NH3, CH4, H2O bileşiklerin Hidrojen olmasına rağmen asit değildir.
Bazı bileşikler yapısında Hidrojen bulundurmaz fakat suda çözündüklerinde H+ iyonu oluştururlar.
CO2 + H2O —–> 2 H+ + CO -2 Karbondioksit
Asitler günlük hayatta ve sanayide kullanılmaktadır. Bazı asitler ve kullanım alanları aşağıda belirtilmiştir.
| Asit | Sistematik Adı | Piyasa adı | Kullanım Alanı |
| HCl | Hidroklorik asit | Tuz ruhu | Temizlik ürünlerinde kullanılır. |
| HNO3 | Nitrik asit | Kezzap | Dinamit yapımında ve gübre üretiminde kullanılır. |
| H2SO4 | Sülfürik asit | Zaç yağı | Gübre ve boya sanayinde, patlayıcı yapımında kullanılır. Aküde asit olarak kullanılır. |
| H3PO4 | Fosforik asit | Fosfat asidi | Gübre üretimi, ilaç ve gıda sanayinde kullanılır. |
Günlük yaşamda sıkça kullandığımız asit örnekler
Sirkede Asetik asit Limonda———– Sitrik asit
Elmada—————————— Malik asit
Çilekte Folik asit Üzümde———- Tartarik asit
Süt, yoğurt—————————– Laktik asit (Yorgunluk asidi)
Turşu, ketçap, meyve suyu————————— Benzoikasit (Koruyucu madde)
Reçel, marmelat—————————- Sorbik asit (Koruyucu madde)
Gazoz————————– Karbonik asit
Kolalı içecekler————————– Fosforik asit
Karınca—————————- Formik asit
pH (Power of Hydrogen) Kavramı
Bir çözeltinin asit yada baz olma derecesi pH derecesi ile ölçülür. pH cetveli 0-14 arasında değişmektedir. 0-7 arası asit, 7-14 arası baz özelliktedir. 7 ise nötrdür.
pH değeri 3 den küçük olanlar kuvvetli asit, pH değeri 12 den büyük olanlar kuvvetli bazdır.
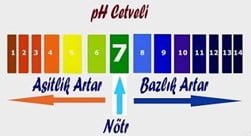
pH Cetveli
Bazı maddeleri pH değerleri
Hidroklorik asit 0 Sülfürik asit 0.3
Mide asidi——————- 1
Nitrik asit——————- 1
Gazlı içecek—————– 2.4
Kola————————– 2.5
Limon———————— 2.3
Sirke————————- 2.9
Portakal suyu————– 3.5
Domates suyu————— 4.2
Asit yağmuru————- –5.6<
Kahve———————— 5.0
Çay————————— 5.5
İdrar————————- 6.0
Süt————————— 6.5
Saf Su————— 7
Tükürük——————— 7.2
Kan————————– 7.4
Göz yaşı————————- 7.4
Safra sıvısı———————- 7-8
Deniz suyu—————— 8.0
El sabunu——————- 10.5
Amonyak——————- 11.5
Kalsiyum hidroksit——– 12.4
Çamaşır suyu————– 12.5
Sodyum hidroksit——— 13.5
Diğer bazlar
Çikolata, mayonez, arap sabunu, cam silme sıvısı, hamur kabartma tozu, mide ilacı, kül
Diğer Asitler
Yoğurt, aspirin
Ayıraç (Belirteç, indikatör)
Ayıraç bir maddeyi başka maddeden ayırt etmemizi sağlayan maddelere ayıraç denir.
Asit ve Bazlarda Kullanılan Bazı Ayıraçlar Turnusol Kağıdı
Asitlerde kırmızı, bazlarda mavi renk alır.
Fenolftalein çözeltisi
Asitlerde renksiz, bazlarda pembe (Kırmızı) renk alır.
Metil Oranj çözeltisi
Asitlerde kırmızı, bazlarda sarı renk alır.
Kırmızı (Mor) Lahana Suyu
Asitlerde kırmızı, bazlarda mavi – yeşil renk alır.
B- Bazlar
Suda çözündüğünde OH– iyonu veren maddelere baz denir.
Bazların Genel Özellikleri
- Tatları acıdır. (Sabun gibi)
- Ele kayganlık hissi verir.
- Sulu çözeltileri elektrik akımını ilatir.
- Kırmızı turnusol kağıdını maviye çevirir.
- Sulu çözeltilerin de OH– iyonu oluşturur.
- Asitlerle tepkimeye girerek tuz ve su oluşturur.
- pH değerleri 7 den büyüktür.
- Metallere etki etmez, ancak amfoter metallere (Zn, Al) kuvvetli bazlar etki
- Cam ve porseleni aşındırır.
- Metallerin oksijenli bileşikleri bazik özellik gösterir.
Önemli Bazlar
NaOH——— > Na+ + OH–
Sodyum hidroksit
KOH———- > K+ + OH–
Potasyum hidroksit
Mg(OH)2———- >Mg+2 + 2OH–
Magnezyum hidroksit
Ca(OH)2———- >Ca+2 + 2OH–
Kalsiyum hidroksit
NH3 + H2O———- > NH4 + + OH–
Amonyak
Not:
Bazı bileşikler yapılarında OH– iyonu içermesine rağmen baz değildir. CH3COOH baz değil asittir.
Bazı bileşiklerin yapısında OH– iyonu içermemesine rağmen bazdır. NH3 baz özellik gösterir.
Bazlar günlük hayatta ve sanayide kullanılmaktadır. Bazı bazlar ve kullanım alanları aşağıda belirtilmiştir.
Temizlik malzemelerinin geneli bazdır.
| Baz | Sistema- tik Adı | Piyasa adı | Kullanım Alanı |
| NaOH | Sodyum hidroksit | Sud kostik | Sabun, kağıt, boya, deterjan, yapay ipek yapımında kullanılır. |
| KOH | Potasyum hidroksit | Potas kostik | Sabun, pil, gübre yapımında kullanılır. |
| Ca(OH)2 | Kalsiyum hidroksit | Sönmüş kireç | Kireç ve çimento yapımında kullanılır. |
| NH3 | Amonyak | Amonyak | Gübre üretimi, temizlik maddeleri, çamaşır suyu yapımında kullanılır. |
C- Asit ve Bazların Tahribatları
Asitler ve bazlar tahriş edici (aşındırıcı) özelliğe sahiptir.
- Asit ve bazları kullanırken, taşırken dikkatli olmamız gerekir.
- Laboratuvar, mutfak, banyoda kullanılan asit ve bazların etkilerinden korunmak için eldiven takılmalı, gözlük kullanılmalıdır.
- Asit ve bazların kullanımında birbiri ile karıştırılmamalıdır. Özellikle tuz ruhu ve çamaşır suyunu kesinlikle karıştırmamalıyız.
- Temizlik yapılan ortamın iyice havalandırılmasını sağlamalıyız.
- Asit ve bazların kullanırken güvenlik işaretlerine dikkat etmeli ambalajında yazan uyarılara uymalıyız.
Asitlerin zararları
Asitler metal, mermer yüzeyleri aşındırır.
Dişlerin çürümesine neden olur.
Asitli içecekler ülser, reflü, gastrit hastalıklarına neden olur.
Bazların zararları
Bazlar cam ve porselen eşyaları aşındırır.
Kristal cam eşyalar zamanla matlaşır.
D- Asit Yağmurları
Fabrika bacalarından, otomobil egzozlarından çıkan zehirli gazlar (SO2, NO2, CO2) havada yağmur damlaları ile birleşerek asit yağmurlarını oluşturur. Asit yağmurunun pH değeri 5.6 dan küçüktür.
SO2 + H2O ——-> H2SO4 (Sülfürik asit)
NO2 + H2O ——-> HNO3 (Nitrik asit)
CO2 + H2O ——-> H2CO3 (Karbonik asit)
Not: CO2 oluşturduğu karbonik asit diğerlerine göre zayıf bir asittir.
Asit yağmurlarında en zararlı olan SO2 ve NO2 dir.
Bu nedenle fosil yakıtlardan en zararsızı doğal gazdır. (Sadece CO2 ve H2O oluşmaktadır.)
Asit Yağmurlarının Zararları
- Topraktaki kalsiyum, magnezyum, potasyum elementlerini çözerek toprağın mineral bakımından fakirleştirir.
- Ormanların kurumasına neden olur.
- Tarihi binalara ve eserlere zarar verir.
- Deniz, göl sularına karışarak burada yaşayan canlıları olumsuz etkiler.
- Araçların ve metal yüzeylerin aşınmasına neden olur.
E- Asit Yağmurlarının Engellenmesi İçin Yapılabilecekler
- Fosil yakıtların kullanımı azaltılmalıdır.
- Fosil yakıtlar yerine yenilenebilir enerji kaynakları kullanılmalıdır.
- Yeşil alan ve ormanlar artırılmalıdır.
- Sanayi tesislerine filtre takılmalıdır.
- Araçların bakımları zamanında yapılmalıdır.
- Kalorisi düşük yakıtlar yerine doğal gaz kullanılmalıdır.
- Kışın yaprak dökmeyen ağaçlar tercih






