Kimyasal Tepkimeler Konu Anlatımı

Kimyasal Tepkimeler Konu Anlatımı: Kimya dünyasındaki reaksiyonların sırlarını keşfedin. Ayrıntılı dersler ve örneklerle.
Kimyasal Tepkime
Maddenin yapısında fiziksel ve kimyasal değişmeler meydana gelir. Fiziksel değişmeler sadece dış görü- nümde meydana gelirken, kimyasal değişmeler maddenin iç yapısında meydana gelir.
Kimyasal değişim, kimyasal tepkimelerle meydana gelir. Demirin paslanması, kağıdın yanması, elmanın çürümesi, ekmeğin küflenmesi kimyasal değişimdir. Bu olaylar kim- yasal tepkimelerle oluşur.
Maddelerin kimyasal değişime uğrayarak yeni maddeler oluşturmasına kimyasal tepkime denir.
A- Kimyasal Tepkimelerin Özellikleri
- Madde özelliklerini kaybeder yeni madde oluşur.
- Kimyasal özellikler değişir.
- Atomlar arasındaki kimyasal bağlar
- Farklı atomlarla yeni bağlar oluşur.
- Kimyasal tepkimeye giren atomların türü ve sayısı değişmez.
- Kimyasal tepkimeye giren maddenin kütlesi ile ürünleri kütleleri eşittir.
- Girenlerin ve ürünlerin molekül sayısı ve hacimleri
Kimyasal Tepkimelerin Yazılması
Kimyasal tepkimeler yazılırken kimyasal denklem şeklinde gösterilir. Tepkimeye (Reaksiyona) girenler sol tarafa, ürünler ise sağ tarafa yazılır.

Kimyasal Denklem
- Tepkimeye girenler ve ürünler birden fazla ise aralarına + işareti konulur.
- Girenler ve ürünler arasına → işareti
Kimyasal Tepkimelerde Kütlenin Korunumu
Bir kimyasal tepkimede var olan madde yok olmaz, yok- tan da madde var edilemez.
Madde içerisindeki atomlar arasındaki bağlar kopar ve yeni bağlar oluşur. Bu nedenle yeni maddeler meydana gelir. Atomların sayısı ve türü değişmemektedir.
Kimyasal tepkimeye giren maddelerin toplam kütlesi ile tepkimeden çıkan maddelerin toplam kütleleri birbirine eşittir. Buna kütlenin korunumu kanunu denir.
Kimyasal Tepkimede Korunanlar
- Atom cinsi ve sayısı
- Kütle
- Toplam proton, nötron ve elektron sayıları
Kimyasal Tepkimede Korunmayabilenler
- Molekül sayısı
- Hacim
- Kimyasal özellikler
Kimyasal Tepkimelerin Grafiği
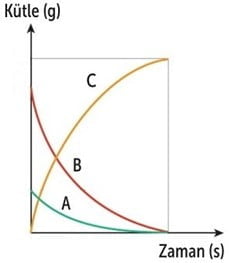
A + B → C
Kimyasal Tepkime Grafiği
- Kimyasal tepkimeye giren maddelerin kütlesi azalır, ürünlerin kütlesi artar.
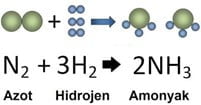
Amonyak Tepkime Denklemi
- Tepkimede molekül sayısı azaldı. (Girenlerde 8 atom, ürünlerde 8 atom vardır)
- Girenlerde toplam molekül sayısı: 1 azot, 3 hidrojen toplam 4 molekül
- Ürünlerde toplam molekül sayısı: 2 amonyak
- Tepkime sonucu oluşan amonyak yeni maddedir.
- Molekül sayısı ve hacim azalmıştır.
- Tepkimede atom sayısı değişmedi. (Girenlerde 8 atom, ürünlerde 8 atom vardır)
- Atom türü değişmemiştir.
- Azot ve hidrojen molekülü içindeki atomlar arasında- ki bağlar kırılır.
- Amonyağın yapısında azot ve hidrojen atomları arasında yeni bağlar oluşur.






